Что такое электродный потенциал?
выбор электродов
«Альтоника», г. Москва
На качество регистрации биосигналов в функциональной диагностике оказывают влияние множество факторов, среди которых немаловажную роль играют свойства электродов. Данная статья посвящена обсуждению влияния электродов на качество регистрации сигналов. Необходимо отметить, что обсуждаемые в статье вопросы в равной степени касаются всех методов исследований, при которых происходит съём биопотенциалов как с поверхности тела, так и с электродов, погруженных в биологические структуры.
Отведение биопотенциалов предполагает преобразование токов, обусловленных движением ионов в биологических жидкостях, в ток, обусловленный движением электронов в металле электрода и соединительных проводниках регистратора. Уже это очевидное положение определяет сложность и многообразие происходящих в месте контакта биологической структуры и электрода процессов.
Рассмотрим простую модель, в которой металлический электрод контактирует с электролитом. При прохождении электрического тока, пусть и минимальной величины, характерной для биообъектов, через границу электролит-металл происходят химические реакции окисления и восстановления металла электрода. Эти реакции протекают даже и при отсутствии внешнего электрического тока. При протекании реакций окисления и восстановления локальная концентрация ионов в непосредственной близости от электрода изменяется относительно средней концентрации ионов в растворе в целом. Это приводит к возникновению разности потенциалов между раствором электролита в целом и части раствора, непосредственно прилегающей к электроду. Данное явление называется электродным потенциалом.
Очевидно, что электродный потенциал зависит как от материала электрода, так и от состава электролита. Оба этих фактора, а также температура, концентрация ионов в растворе и др, определяют характеристики протекающих химических реакций в непосредственной близости от электрода, которые и создают электродный потенциал.
В качестве эталона для измерения электродных потенциалов используют потенциал химической реакции Н2 → 2Н + + 2е — (так называемый водородный электрод). По отношению к потенциалу водородного электрода все электроды могут быть разделены на поляризуемые и неполяризуемые. Естественно, идеальных поляризуемых или неполяризуемых электродов не существует, однако с определенной долей приближения те или иные конструкции электродов можно отнести к одному из классов.
Необходимо учитывать, что регистрация биопотенциалов всегда ведется между парой (или большим числом) электродов, поэтому свойства всех электродов, участвующих в формировании измерительной электрической цепи, должны рассматриваться в совокупности. При различных свойствах электродов одной измерительной цепи вследствие разной поляризации возможно возникновение разности межэлектродных потенциалов (РМЭП). Усилители биопотенциалов проектируются таким образом, чтобы было можно без существенных искажений сигнала компенсировать РМЭП. Однако, при превышении РМЭП допустимого для данного усилителя значения возможно искажение регистрируемого сигнала или даже переход усилителя в состояние «насыщения», когда регистрация сигнала вообще становится невозможной.
Величина РМЭП может быть относительно стабильной, но при определенных условиях она может изменятся с течением времени. Такое явление носит название дрейфа РМЭП. С практической точки зрения дрейф РЭМП должен рассматриваться отдельно для случаев кратковременной и продолжительной регистрации биосигналов. При значительном изменении РМЭП во время регистрации будет наблюдаться дрейф изоэлектрической линии, а при длительной регистрации возможно насыщение усилителей с неизбежными искажениями сигнала.
Если поверхность электрода электрически неоднородна, то могут возникать области с локальными изменениями концентраций ионов. Поскольку электрохимическая система электрода постоянно находится в динамическом равновесии (т.е. химические реакции в ней протекают постоянно, но уравновешивают друг друга), то такие локальные изменения концентрации ионов приведут к возникновению локальных токов, часть которых может оказаться в полосе частот полезного сигнала. Эта часть токов будет обуславливать т.н. электродный шум. Важно отметить, что электрическая неоднородность поверхности электрода может возникнуть из-за банального загрязнения поверхности электрода.
При смещении электрода может происходить перераспределение зарядов вблизи его поверхности. Результатом является кратковременное изменение электродного потенциала, которое продолжается до тех пор, пока равновесие в электрохимической системе электрода не установится вновь. Этот эффект носит название электромеханического шума движения.
Изучение сигналов артефактов движения показало, что их спектр в основном лежит в той же области, что и основные биологические сигналы. Этот факт делает использование фильтрации не самым эффективным методом уменьшения влияния шума движения на качество сигнала. Более эффективны для борьбы с электромеханическим шумом движения неполяризующиеся электроды, снижение сопротивления эпидермиса, предотвращение прямого контакта электрода с кожей, стабилизация положения электрода относительно биообъекта и расслабление мышц в процессе регистрации. Наибольшую проблему электромеханический шум представляет при длительном мониторировании биосигналов.
Немаловажной характеристикой электродов, обусловленной перераспределением ионов вблизи электрода, является устойчить к длительному малому постоянному току. Во входных цепях усилителей биосигналов могут возникать очень небольшие по величине постоянные токи (стандарты нормируют предельные величины этих токов на уровнях единиц наноампер). Любой постоянный ток будет приводить к перераспределению ионов в растворе электролита, что в свою очередь приведет к изменению электродного потенциала. Наибольшую проблему представляет данный эффект при длительной регистрации биосигнала. Неполяризуемые электроды, как правило, имеют более высокую устойчивость к этому негативному эффекту.
Для электрокардиографической практики также важно восстановление свойств электродов и всей регистрирующей системы после разряда дефибриллятора. При протекании через электродные цепи значительных по величине токов возникает существенное перераспределение концентраций ионов вблизи электродов. Не рассматривая детально происходящие при этом процессы, отметим при сочетании неблагоприятных факторов возможно заметное увеличение РМЭП с последующей стабилизацией потенциалов. Это может привести к невозможности регистрации ЭКГ в течение некоторого времени. Существенно, что возобновление отображения ЭКГ в течение установленного стандартом периода (5 с) возможно только с использованием неполяризуемых или малополяризуемых электродов при выполнении специальных требований к конструкции кабеля пациента и входным цепям электрокардиографического оборудования.
Наиболее распространёнными неполяризуемыми электродами в настоящее время являются хлорсеребряные ( Ag / AgCI ). Распространены две основных конструкции таких электродов. В первой серебряную (или, для снижения цены, посеребрённую) пластину покрывают электролитическим способом слоем хлорида серебра. В другой распространенной конструкции на проводящую подложку наносится смесь порошков серебра и хлорида серебра, которая спекаются с подложкой.
Работа хлорсеребряного электрода обусловлена протеканием двух химических реакций:
Ад ↔ Ад + + е —
Первая реакция приводит к окислению серебра с выделением электрона. Вторая реакция начинается непосредственно после образования иона серебра и приводит к получению его хлорида.
Ион хлора для этой реакции должен поступить из окружающего электролита, поэтому достаточная концентрация ионов хлора в окружающем электролите является необходимым условием работы такого электрода. Для большинства биологических жидкостей и применяемых проводящих сред это условие выполняется.
Хлорид серебра не растворим в воде, поэтому электрод не сильно разрушается в процессе эксплуатации. Однако, хлорид серебра плохо проводит электрический ток, поэтому его слой не должен быть слишком толстым. С другой стороны, повреждение поверхностного слоя электрода может привести к нарушению работы хлорсеребряного электрода.
Подчеркнем, что условием нормального функционирования хлорсеребряного электрода является достаточная концентрация ионов хлора в контактной проводящей среде. Однако в последние годы появились разработки электродов, не требующих
обязательного использования электродного геля. Поверхность таких электродов имеет специально выполненные микронеровности с регулярной или нерегулярной структурой, которые позволяют добиться хороших свойств электродов без нанесения проводящего геля. Между тем, в некоторых случаях может быть необходимо на несение на кожу маловязкой проводящей среды.
Кроме низкого потенциала поляризации относительно биологических жидкостей, положительными качествами хлорсеребряных электродов являются низкий уровень собственных шумов и стабильность импеданса (полного сопротивления) в зависимости от частоты. Хлорсеребряные электроды хорошего качества также достаточно быстро восстанавливают потенциал после внешних электрических воздействий, что может произойти, во время дефибрилляции.
Кроме электрических характеристик электродов их существенными для эксплуатации свойствами являются размеры, форма, способ крепления на поверхности биообъекта и другие механические характеристики. При выборе электродов надо обращать внимание на соответствие этих характеристик области применения электродов в конкретных условиях.
Таким образом, на электрические свойства электродов для регистрации биопотенциалов оказывают непосредственное влияние:
— материал и покрытие электрода;
— состояние и электрическая однородность поверхности электрода;
— свойства электродной проводящей среды, при использовании прокладок — толщина и свойства прокладки;
-электрические свойства тканей биообъекта, с которых осуществляется съём биопотенциалов;
— воздействие на биообъект электрических токов и полей, включая электростимуляцию, дефибрилляцию, исследование импеданса тканей и др, а также наводок от другого электрического оборудования.
При одновременном использовании нескольких электродов для синхронной регистрации нескольких биосигналов, что является самым частым случаем в современной диагностической практике, необходимо учитывать следующие требования:
— все электроды комплекта должны быть одной электрохимической системы;
— все электроды комплекта должны иметь приблизительно одинаковую степень износа (следствием является требование одновременной замены всех электродов комплекта);
— для всех электродов необходимо использовать качественную и одинаковую проводящую среду.
Несоблюдение этих требований может привести к возникновению различных потенциалов (природа которых рассмотрена выше) между электродами, что неизбежно снизит качество регистрации сигналов.
В таблице суммированы данные о влиянии различных потенциалов, возникающих на электродах, на качество регистрации биосигналов. Необходимо отметить, что помехи могут наблюдаться как изолированно, так и в совокупности, что затрудняет распознавание их природы. Понимание природы возникающих потенциалов важно для уменьшения их неблагоприятного влияния на качество регистрируемых сигналов.
Возможное негативное влияние
Разность межэлектродных потенциалов
Перегрузка усилителей, ограничения и другие искажения сигналов
Дрейф разности межэлектродных потенциалов
Появление на записи шумов в различных диапазонах частот (чаще всего, в
Электромеханический шум движения
Отдельные импульсные помехи
Высокочастотный постоянный и периодический шум
Поляризация электрода или границ тканей биообъекта (например, эпидермиса) вследствие протекания малого постоянного тока
Перегрузка усилителей, ограничения и другие искажения сигнала
Поляризация вследствие протекания значительных токов (например, при дефибрилляции)
Перегрузка усилителей, ограничения и другие искажения сигнала
В процессе эксплуатации следует своевременно производить очистку электродов. Очистка необходима не только для соблюдения требований санэпидрежима, но для сохранения приемлемого качества регистрации сигналов. Очистка должна производиться по инструкции производителя. Высыхание на поверхности электродов электродного геля или иных загрязнений часто приводит к деструкции покрытия электродов. Абсолютно недопустимо использовать для чистки поверхности электродов твердые и острые предметы, абразивы, жесткие мочалки, агрессивные жидкости и т.п. Механические или химические воздействия на поверхность электродов приведёт к порче и необратимому ухудшению электрохимических свойств электрода.
В завершении обзора проблем регистрации биосигналов, связанных с электродами, отметим, что любые многоразовые электроды имеют ограниченный деструкцией их поверхностного слоя срок службы. Проявлением деструкции покрытия может быть
изменение цвета, появление на поверхности электродов нехарактерных отложений, обнажение подложки и другие повреждение которые могут быть легко и своевременно выявлены осмотром. Наиболее вероятные места деструкции покрытия — углы и кромки электродов, где покрытие подвержено наиболее интенсивне му износу. При выявлении повреждений даже одного электрода необходимо заменять весь комплект или подбирать на замен) электрод с теми же характеристиками, что и заменяемый.
Таким образом, электроды оказывают существенное влияние на качество регистрации биосигналов. Несоответствие характеристик электродов требованиям регистрации конкретного сигнала может приводить к различным артефактам в записях или даже имитировать неисправности электродиагностической аппаратуры.
Журнал «Функциональная дигностика» №3 2010 г .
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник. В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток. Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом. Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
- Природа вещества (окислителя и восстановителя)
- Концентрация окисленной и восстановленной форм. При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
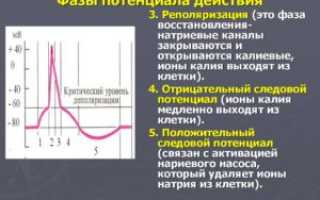
При Cок >Cвос, E >E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + . Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С. Такие таблицы дают возможность сделать некоторые выводы: E°(F2/2F — ) = +2,87 В – сильнейший окислитель E°(K + /K) = — 2,924 В – сильнейший восстановитель Данная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал. Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+ Практически протекает в прямом направлении, т.к. E° (Sn 4+ /Sn 2+ ) = +0,15 В, а E° (Fe 3+ /Fe 2+ ) = +0,77 В, т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ). Cu + Fe 2+ = Cu 2+ + Fe невозможна в прямом направлении и протекает только справа налево, т.к. E° (Сu 2+ /Cu) = +0,34 В, а E° (Fe 2+ /Fe) = — 0,44 В, т.е. E° (Fe 2+ /Fe) 2+ /Cu). В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются. Рассмотрим несколько реакций и определим их ЭДС: E° (Mg 2+ /Mg) = — 2,36 В E° (Fe 2+ /Fe) = — 0,44 В Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0. Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия. Например, для реакции Zn + Cu 2+ = Zn 2+ + Cu Применяя закон действующих масс, можно записать Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди. Значение константы равновесия можно вычислить, применив уравнение Нернста Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка. Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой: lgK = (E1 0 -E2 0 )n/0,059, где K — константа равновесия E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно n – число электронов, отдаваемых восстановителем или принимаемых окислителем. Если E1 0 > E2 0 , то lgK > 0 и K > 1. Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца. Напротив, если E1 0 0 , то K будет очень мала. Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий. Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции. По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций. Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции: Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод). Например, составим схему гальванического элемента, в котором осуществляется следующая реакция: Fe 0 + Cd 2+ = Fe 2+ + Cd 0 В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый. Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод Типичные задачи с решениями вы найдете здесь. Между наружной поверхностью клетки и ее цитоплазмой в состоянии покоя существует разность потенциалов около 0,06-0,09 в, причем поверхность клетки заряжена электроположительно по отношению к цитоплазме. Эту разность потенциалов называют потенциалом покоя или мембранным потенциалом. Точное измерение потенциала покоя возможно только с помощью микроэлектродов, предназначенных для внутриклеточного отведения токов, очень мощных усилителей и чувствительных регистрирующих приборов – осциллографов. Микроэлектрод (рис. 67, 69) представляет собой тонкий стеклянный капилляр, кончик которого имеет диаметр около 1 мкм. Этот капилляр заполняют солевым раствором, погружают в него металлический электрод и соединяют с усилителем и осциллографом (рис. 68). Как только микроэлектрод прокалывает покрывающую клетку мембрану, луч осциллографа отклоняется вниз из своего исходного положения и устанавливается на новом уровне. Это свидетельствует о наличии разности потенциалов между наружной и внутренней поверхностью клеточной мембраны. Рис. 67. Стеклянные микроэлектроды: А – одноканальный; Б – двухканальный; справа- кончик микроэлектрода около тела нейрона Рис. 68. Измерение электрической активности мышечного волокна (А) с помощью микроэлектрода (схема): М – микроэлектрод; И – индифферентный электрод. Луч на экране осциллографа (Б) показывает, что до прокола микроэлектродом мембраны разность потенциалов между М и И была равна нулю. В момент прокола (показан стрелкой) обнаружена разность потенциалов, указывающая, что внутренняя сторона мембраны заряжена электроотрицательно по отношению к ее наружной поверхности Наиболее полно происхождение потенциала покоя объясняет так называемая мембранно-ионная теория. Согласно этой теории все клетки покрыты мембраной, имеющей неодинаковую проницаемость для различных ионов. В связи с этим внутри клетки в цитоплазме в 30-50 раз больше ионов калия, в 8-10 раз меньше ионов натрия и в 50 раз меньше ионов хлора, чем на поверхности. В состоянии покоя клеточная мембрана более проницаема для ионов калия, чем для ионов натрия. Диффузия положительно заряженных ионов калия из цитоплазмы на поверхность клетки придает наружной поверхности мембраны положительный заряд. Таким образом, поверхность клетки в покое несет на себе положительный заряд, тогда как внутренняя сторона мембраны оказывается заряженной отрицательно за счет ионов хлора, аминокислот и других крупных органических анионов, которые через мембрану практически не проникают (рис. 70). Если участок нервного или мышечного волокна подвергнуть действию достаточно сильного раздражителя, то в этом участке возникает возбуждение, проявляющееся в быстром колебании мембранного потенциала и называемое потенциалом действия. Потенциал действия можно зарегистрировать либо с помощью электродов, приложенных к внешней поверхности волокна (внеклеточное отведение), либо микроэлектрода, введенного в цитоплазму (внутриклеточное отведение). При внеклеточном отведении можно обнаружить, что поверхность возбужденного участка на очень короткий период, измеряемый тысячными долями секунды, становится заряженной электроотрицательно по отношению к покоящемуся участку. Рис. 69. Манипулятор (А) и микроэлектрод (Б) на голове кролика Рис. 70. Схема неповрежденного поляризованного нервного волокна Причина возникновения потенциала действия – изменение ионной проницаемости мембраны. При раздражении проницаемость клеточной мембраны для ионов натрия повышается. Ионы натрия стремятся внутрь клетки, так как, во-первых, они заряжены положительно и их влекут внутрь электростатические силы, во-вторых, концентрация их внутри клетки невелика. В покое клеточная мембрана была малопроницаемой для ионов натрия. Раздражение изменило проницаемость мембраны, и поток положительно заряженных ионов натрия из внешней среды клетки в цитоплазму значительно превышает поток ионов калия из клетки наружу. В результате внутренняя поверхность мембраны становится заряженной положительно, а наружная вследствие потери положительно заряженных ионов натрия отрицательно. В этот момент и регистрируется пик потенциала действия. Повышение проницаемости мембраны для ионов натрия продолжается очень короткое время. Вслед за этим в клетке возникают восстановительные процессы, приводящие к тому, что проницаемость мембраны для ионов натрия вновь понижается, а для ионов калия возрастает. Поскольку ионы калия также заряжены положительно, то, выходя из клетки, они восстанавливают исходные отношения снаружи и внутри клетки. Накопления ионов натрия внутри клетки при многократном возбуждении ее не происходит потому, что ионы натрия эвакуируются из нее постоянно за счет действия специального биохимического механизма, называемого “натриевым насосом”. Есть данные и об активном транспорте ионов калия с помощью “натрий-калиевого насоса”. Таким образом, согласно мембранно-ионной теории в происхождении биоэлектрических явлений решающее значение имеет избирательная проницаемость клеточной мембраны, обусловливающая разный ионный состав на поверхности и внутри клетки, а следовательно, и разный заряд этих поверхностей. Следует заметить, что многие положения мембранно-ионной теории все еще дискуссионны и нуждаются в дальнейшей разработке.Итак, Как определить ЭДС реакции?
Константа равновесия.
Как составить схему гальванического элемента?
2. Потенциал покоя и потенциал действия [1976 – – Физиология человека]
Потенциал действия